Universeel klemeiwit stabiliseert andere eiwitten
Nieuw inzicht in werkingsmechanisme chaperonne-eiwit Hsp70
Op 26 oktober publiceert Nature een onderzoek dat een decennia oud model voor de werking van een cruciaal eiwit omverwerpt. Onderzoekers van FOM-instituut AMOLF en de Universiteit van Heidelberg laten zien dat het eiwit Hsp70 gevouwen eiwitten mechanisch stabiliseert met een beweegbare klep, en hen zo beschermt tegen stress en schade. Deze kennis van hoe eiwitten elkaar helpen, maakt het mogelijk verschillende cellulaire processen op een nieuwe manier te begrijpen en uiteindelijk meer inzicht te krijgen in ziektes als kanker en Parkinson, waarbij falen van eiwitten een belangrijke rol speelt.
“Eiwitten regelen gezamenlijk vrijwel alle processen in levende cellen. Ze binden kort aan elkaar, katalyseren wellicht een bepaalde reactie en laten dan weer los. De meeste eiwitten hebben specifieke bindings-partners, maar sommigen hebben een universelere functie”, zegt AMOLF-groepsleider Sander Tans die als hoofd van de Biophysics groep van AMOLF onderzoek doet naar zulke chaperonne-eiwitten. “Vergelijk het met gereedschap: voor elke klus bestaat specifiek gereedschap, maar met een universele tang kun je heel veel klussen aanpakken. Een chaperonne-eiwit is zo’n universele klemtang die zich aan elk ander eiwit kan binden en daarmee de functie van dat eiwit kan ondersteunen of verhinderen.”
Enkele eiwitten op de pijnbank
In experimenten met een optisch pincet onderzochten Tans en zijn collega’s de functie van Hsp70. “Met deze techniek kunnen we één enkel eiwit oppakken en het op een gecontroleerde manier beschadigen door eraan te trekken – we leggen het eiwit op een pijnbank”, zegt hij. “Normaal zorgt dit trekken ervoor dat het eiwit zich uitstrekt, wat we ontvouwen noemen. Tot onze verrassing ontdekten we dat Hsp70 het eiwit beschermt en zorgt dat het vrijwel volledig intact blijft. Het was vrijwel onmogelijk om een gevouwen eiwit te strekken en beschadigen als Hsp70 eraan gebonden was.”
Dit resultaat was verrassend omdat in elk tekstboek staat dat Hsp70 zich graag bindt aan peptideketens. Die liggen open wanneer een eiwit nog wordt gemaakt, of als het beschadigd of anderszins ontvouwen raakt. Volgens het tekstboekmodel kan Hsp70 dus de uitgerekte en ontvouwen toestand van een eiwit stabiliseren, en niet de gevouwen toestand waarin de peptideketens netjes weggestopt zitten. Er zijn ook geen andere eiwitten bekend die op een universele manier andere eiwitten kunnen stabiliseren.
Een geautomatiseerde mechanische klem
“Dit chaperonne-eiwit is een behoorlijk complex systeem”, zegt Tans. “Hsp70 verandert voortdurend ingrijpend van vorm tijdens het verbranden van ATP, een brandstofmolecuul met dezelfde functie als benzine in een motor. Een deel van het eiwit werkt als een soort klem die zich opent en sluit. Dit verklaart ook de universele functie: net als in gereedschap passen er dan eiwitten van verschillende vorm en grootte in. Deze bewegingen gaan normaal gesproken erg snel, maar wij gebruikten een truc om de verbrandingscyclus te doorbreken. Het bleek dat wanneer we veel verbrande ATP moleculen toevoegden, Hsp70 zich langdurig aan een eiwit bond en het zo stabiliseerde. Dat is best logisch, want we weten uit de biologie dat verbrande ATP zich ophoopt in cellen onder stress waarvan de eiwitten bescherming nodig hebben. In andere experimenten zagen we dat eiwitten ook beter bestand waren tegen hoge temperaturen en dus stabieler waren in aanwezigheid van Hsp70.”
Beter begrip van eiwitten
Het onderzoek laat zien dat bestaande modellen van hoe HsP70 zijn taken uitvoert, bijgesteld moeten worden. “We moeten de vele functies van deze chaperonne in de cel nu met een nieuwe bril bekijken. Zo zou het kunnen dat Hsp70 de activiteit van enzymen moduleert door zich direct aan hen te binden”, zegt Tans. “Met een beter begrip van wat Hsp70 doet en welke delen van het eiwit waarbij betrokken zijn, kunnen we uiteindelijk effectiever zoeken naar manieren om falende eiwitprocessen te repareren in de vele ziekten waarin het een rol speelt.”
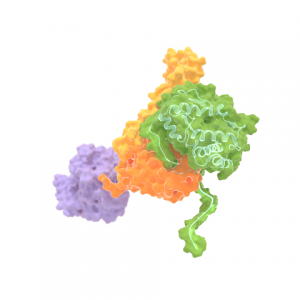
Artist impression van HsP70 dat een ander eiwit (groen) vastklemt tussen twee domeinen (geel en oranje). Het derde onderdeel van Hsp70 (paars) bindt ATP. Uit het onderzoek van Tans en zijn collega’s blijkt dat Hsp70 niet alleen uitgestrekte eiwitketens bindt, wat eiwitten destabiliseert. Hsp70 kan ook het tegenovergestelde doen: eiwitten stabiliseren door deze te binden in gevouwen toestand. Deze bevinding heeft implicaties voor de vele essentiële taken van Hsp70 in cellen.
Bron: M. Avellaneda & S. Tans
Referentie
Alternative modes of client binding enable functional plasticity of Hsp70, Alireza Mashaghi, Sergey Bezrukavnikov, David P. Minde, Anne S. Wentink, Roman Kityk, Beate Zachmann-Brand, Matthias Mayer, Günter Kramer, Bernd Bukau, and Sander J. Tans, Nature (2016) DOI: 10.1038/nature20137
Meer informatie
Het onderzoek van Tans is gedeeltelijk gefinancierd door het onderdeel Aard en Levenswetenschappen (ALW), de Stichting voor Fundamenteel Onderzoek der Materie (FOM) van de Nederlandse Organisatie voor Wetenschappelijk Onderzoek (NWO).